Team:Chiba/jk/γ/Trl
From 2008.igem.org
(Difference between revisions)
(→Time Responce Liquid) |
|||
| Line 7: | Line 7: | ||
インダクションをかけてからいち早く、確認できる出力を見つけること | インダクションをかけてからいち早く、確認できる出力を見つけること | ||
<br>To find the earliest output gene after induction | <br>To find the earliest output gene after induction | ||
| + | |||
| + | ===Reporter=== | ||
| + | *Fluorescent Protein | ||
| + | :*GFP | ||
| + | ::*pGFPuv | ||
| + | ::BBa_T9002 | ||
| + | :*Venus YFP | ||
| + | ::*BBa_K084003 | ||
| + | :::*pLac-Venus YFP | ||
| + | :*mCherry | ||
| + | pLac-mCherry | ||
| + | *β-gal (X-gal assay) | ||
| + | pUC19(plac-LacZα) | ||
| + | |||
===Equipment=== | ===Equipment=== | ||
Revision as of 01:49, 30 October 2008
Contents |
Time Responce Liquid
purpose
インダクションをかけてからいち早く、確認できる出力を見つけること
To find the earliest output gene after induction
Reporter
- Fluorescent Protein
- GFP
- pGFPuv
- BBa_T9002
- Venus YFP
- BBa_K084003
- pLac-Venus YFP
- mCherry
pLac-mCherry
- β-gal (X-gal assay)
pUC19(plac-LacZα)
Equipment
- shaking incubator
- Innova 4200 Benchtop or Floor-Stackable Incubator Shaker(37°C)
- 46-well plate(deep well)
- 96-well plate(deep well)
- Fluoroskan Ascent 2.5(program:Ascent Software Version 2.6)
- Beckman Allegratm X-12R Centrifuga(Beckman Coulter)
Method
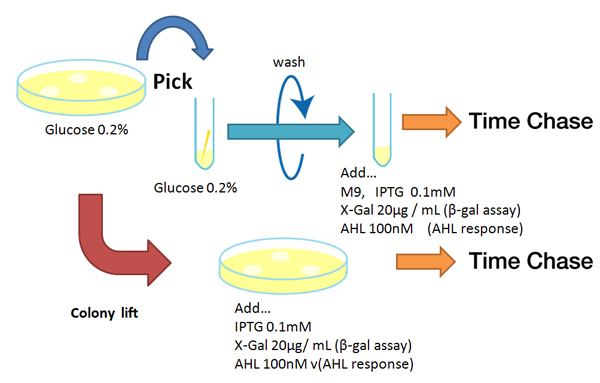
Strain:XL10G KanR
- Liquid medium experiment
- Pre-culture
- Picked and cultured the following plate in 2mL of LB:
- LB-Amp+0.2 % Glucose, (pGFPuv, pLac-Venus YFP, pLac-mCherry, pUC19)
- LB-Amp, ([http://partsregistry.org/Part:BBa_T9002 BBa_T9002], [http://partsregistry.org/Part:BBa_K084003 BBa_K084003])
- Cultured at 37°C for 12h.
- Picked and cultured the following plate in 2mL of LB:
- Culture
- Dilute pre-cultures and add to new LB medium.
- LB-Amp+0.2 % Glucose, (pGFPuv, pLac-Venus YFP, pLac-mCherry, pUC19)
- LB-Amp, ([http://partsregistry.org/Part:BBa_T9002 BBa_T9002], [http://partsregistry.org/Part:BBa_K084003 BBa_K084003])
- Cultured at 37°C for about 6 h
- Dilute pre-cultures and add to new LB medium.
- Wash
- Transfer 10mL each of the culture to 50mL centrifuge tubes.
- Centrifuged for 6min at 3600rpm,20°C and discarded the supernatant.
- Add physiological saline and resuspention
- Repeated wash twice.
- Add M9 minimal medium.
- Mix
- Dispens each culture into 48-well deep well or 96-well deep well
- Add IPTG fainal conc. 0.2 mM (pGFPuv, pLac-Venus YFP, pLac-mCherry, pUC19)
- Add AHL fainal conc. 100nM ([http://partsregistry.org/Part:BBa_T9002 BBa_T9002], [http://partsregistry.org/Part:BBa_K084003 BBa_K084003])
- Measure fluorescence intensity every 1 h.
Result
Discussion
このプロジェクトでは、発現するまでの時間を変えることが目的である
- X-galの濃度を高くすると発現を確認できるまでの時間は短くなったが、蛍光たんぱくで発現を確認できるまでの時間より遅い
- X-galを基質とするβ-galでは、時間がたつごとに基質濃度が下がり、出力までの時間が長くなってしまうことも考えられる
以上の2つの理由から蛍光タンパク質が適している
またGFP,YFPの発現時間までのタイムラグが一番少なかった
- 目視で確認した際、GFPのほうがYFPよりも目視で確認するのが容易であった
以上の理由から、出力はGFPとする。
| ホーム | メンバー紹介 | プロジェクト紹介 | Parts Submitted to the Registry | モデリング | ノート |
|---|
 "
"