Team:KULeuven/Concreties
From 2008.igem.org
(→Project D) |
(→Output) |
||
| Line 22: | Line 22: | ||
==Output== | ==Output== | ||
| + | Als output is GFP waarschijnlijk het handigste. Dankzij een C-terminale tag ([http://aem.asm.org/cgi/content/full/64/6/2240?view=long&pmid=9603842 RPAADNYALAA]) kan de half-life verminderd worden tot 40min tot enkele uren. | ||
| + | Ik stel volgende output module voor: | ||
| + | * '''BBa_I12007''': promoter, geïnduceerd door cI, geen repressie dankzij OR3 mutatie | ||
| + | * '''BBa_B0034''': RBS | ||
| + | * '''BBa_XXXXX''': Onstabiel GFP (vb GFP-RPAADNYALAA) | ||
| + | * '''BBa_B0010''': terminator | ||
| + | * '''BBa_B0012''': terminator | ||
| + | [[User:Bmoeyaert|Bmoeyaert]] | ||
==Filter== | ==Filter== | ||
Revision as of 10:16, 6 July 2008
Op deze pagina verzamelen we concrete invullingen omtrent het project. De bedoeling is niet meer om over conceptuele dingen na te denken, maar om bijvoorbeeld op zoek te gaan naar analogen met vorige projecten, bruikbare BioBricks enzoverder. Voorlopig gooien we het nog niet onmiddellijk op de voorgrond, tot we meer voet in de aarde hebben omtrent haalbaarheid en zo.
Contents[hide] |
Project PI
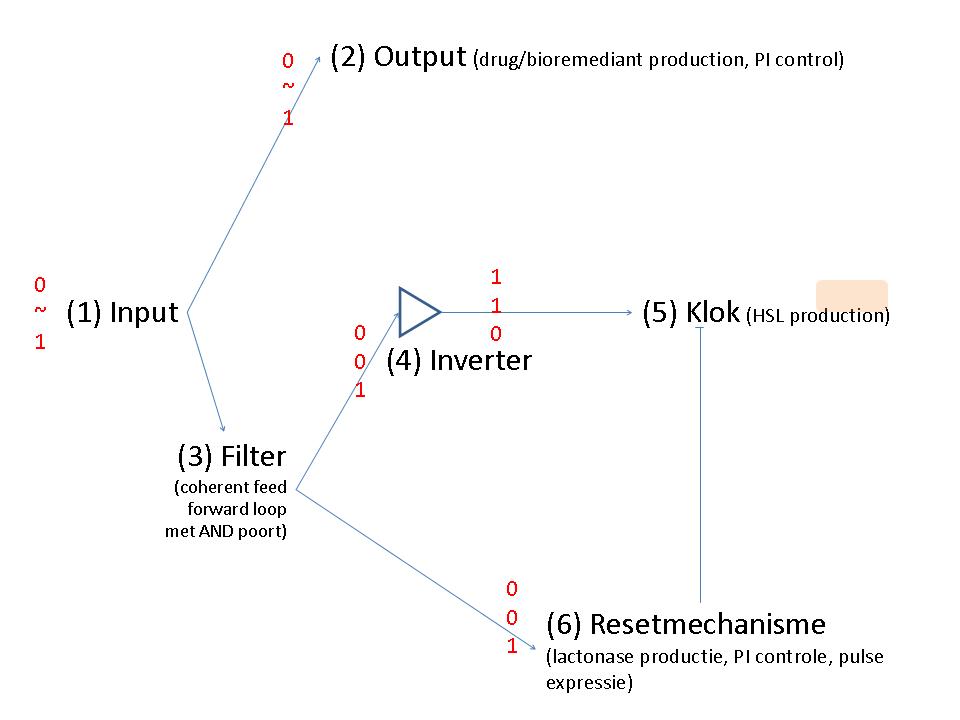
Input
The input could be abstracted by using an easily controllable light flash.
- The system of the Austin 2004 iGEM team cannot be used (or is better not used), because the light flash inhibits the promoter, where we need a light flash that activates a promoter.
- Aparently, OmpR-P has a different effect on ompC and ompR (see [http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=106865 this paper]). In Levskaya et al, they used the promoter of ompC BBa_R0082, which would indeed not be useful for us since a flash of light would inhibit autophosphorylation of the sensor, and thus OmpR and hence turn the system off. Maybe we can use the promoter of ompF? The team of [http://openwetware.org/wiki/IGEM:Melbourne/2008/BioClock/SPModel Melbourne] is using the promoter of ompF, that's where I got the inspiration to use the flash light as a dummy input. Maybe other dummy inputs are possible? Light has the advantage of being easy to manipulate of course. -Ingethijs 14:39, 3 July 2008 (UTC)
- Indeed, OmpF is activated by OmpR (without phosphate) and is repressed by OmpR-P. See [http://www.jbc.org/cgi/reprint/269/17/12559 this paper]. The OmpF promoter is available as BioBrick BBa_R0084. This could be a feasible mechanism for dummy input. - Bmoeyaert
- There is a BioBrick (BBa_I765001) that is induced by UV-light. This would be perfect: only UV light could than trigger our system. This BioBrick is not confirmed to work, and there is very little information availabla about it. I doubt its proper working, however.
- Harvard 2005 also did something with UV. It involved the lambda cI repressor, and resulted in UV light switching something on. I do not (yet) understand how it works. See http://openwetware.org/images/8/86/Doucette_et_al._2006.pdf.
Output
Als output is GFP waarschijnlijk het handigste. Dankzij een C-terminale tag ([http://aem.asm.org/cgi/content/full/64/6/2240?view=long&pmid=9603842 RPAADNYALAA]) kan de half-life verminderd worden tot 40min tot enkele uren. Ik stel volgende output module voor:
- BBa_I12007: promoter, geïnduceerd door cI, geen repressie dankzij OR3 mutatie
- BBa_B0034: RBS
- BBa_XXXXX: Onstabiel GFP (vb GFP-RPAADNYALAA)
- BBa_B0010: terminator
- BBa_B0012: terminator
Filter
This is what I found (up to now).
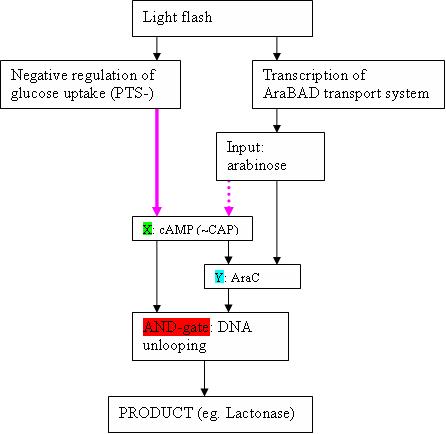
- In the paper of Shen-Orr , the example of the feedforward loop with AND-gate is the well-studied Ara-operon (This can occur when X and Y act in an ‘AND-gate’−like manner to control operon Z, as is the case in the araBAD operon in the arabinose feedforward loop)
- Is dit het enige voorbeeld dat ze aanhalen in shen-orr? misschien is dit systeem nogal moeilijk omvormbaar naar een specifieke filter vermits cAMP nogal een belangrijke rol speelt in de cel – het idee was dan ook om de input van X te veranderen in een induceerbare promoter naar keuze, bijv een OmpR afhankelijke als we het systeen van levskaya met de lichtpuls gebruiken -- IT
- The input signal is of course arabinose. We will need AraF(GH?) to transport it efficiently from the medium into the cell.
- What is depicted (see figure) as X, is cAMP (+ CAP)
- Y is AraC
- The AND gate is the “unlooping” of the DNA strand in de Ara operon. This happens only in the presence of both AraC bound to arabinose, and CAP-cAMP
- Product Z are in a WT Ara operon the AraBAD proteïns, but can of course be changed to eg. lactonase. The araBAD genes are located downstream the pBAD promoter, which is activated by the “DNA unlooping”.
- Kan Z ook een tussenproduct zijn dat enerzijds de inverter ingaat richting HSL productie en anderzijds, na het ribolock-key systeem, lactonase productie aanstuurt -- IT
Note that Y is also to be stimulated by arabinose, so the scheme is actually a bit more complex than the easy scheme depicted in the Shen-Orr paper
Some problems
- I cannot find literature about the dotted purple arrow: is it überhaupt existing? The article of Shen-Orr suggests it does.
- cAMP concentration is depressed by glucose, so maybe the purple arrow means that the concentration of glucose is negligible compared to arabinose. This might however not be good enough.
- What could be done, is making sure that not only AraBAD is made upon (eg) flashing with a light (Austin iGEM 2004), but also making a repressor for the phosphotransferase system of glucose transport. However, then, the pink purple arrow should be the full (non-dotted) pink one.
- I did not (yet) find the BioBricks of the Austin 2004 team for the input signal.
- I believe they can be found here: http://partsregistry.org/Featured_Parts:Light_Sensor -- IT
- Adenylate cyclase inhibition is coupled to the flux of glucose through the glucose PEP:phosphotransferase system . This means that external glucose concentration regulates cAMP production. This is I think a major problem: how do we arrange the system so that it becomes dependent on cytoplasmatic factors?
- Vandaar dat ik hoop dat er nog een ander systeem in E.coli gekend is dat dit netwerkmotief heeft, daar waren we een beetje vanuit gegaan... -- IT
- Ik denk dat het systeem zoals hierboven uitgelegd moet lukken. Prof. Winderickx vertelde dat cAMP zowel afhankelijk is van intra- als extracellulaire glucose-concentratie. Dat lost het probleem hier geformuleerd op. Daarenboven klinkt de paper die hieronder geciteerd staat zeer veelbelovend, zij hebben immers al uitvoerig het ara-operon in min of meer hetzelfde perspectief als hier beschreven bestudeerd. Bmoeyaert
- If cAMP is not degraded fast enough, could cyclic nucleotide phosphodiesterases catalyse this process of degradation?
Interesting reads
- http://www.weizmann.ac.il/mcb/UriAlon/Papers/The%20Coherent%20Feedforward%20Loop%20Serves%20as%20a%20Sign-sensitive%20Delay%20Element%20in%20Transcription%20Networks.pdf
Inverter
Klok
Resetmechanisme
Project D
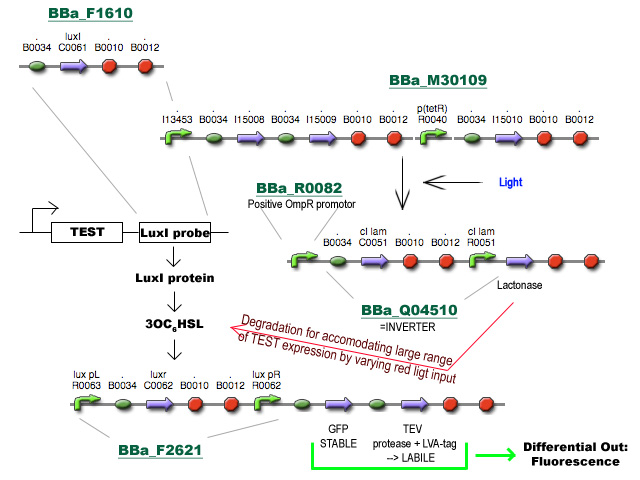
Zoals gevraagd, een concrete blik op Project D:
Ik ben ertrokken van het voorstel van Prof. Robben en heb nog een stukje toegevoegd om tegemoet te komen aan de brede range van expressieniveaus in de cel. Het gebruik van HSL synthese en degradatie (vanuit andere voorstellen) zorgt respectievelijk voor amplificatie van het signaal van differentiele regulatie en voor het verhogen van de dynamic range van expressieniveaus die het systeem aankan via belichting met rood licht op verschillende intensiteiten. Enfin, I had fun. Gooi er maar vragen/opmerkingen onder :)
(Begin linksboven) -Jonas 17:13, 5 July 2008 (UTC)
- Ik zie dat je gebruikt maakt van de pBAD promoter en de OmpR regulator. Indien we dit willen integreren met het project hierboven, zal ofwel deze stap, ofwel de input andere vorm moeten aannemen, want beide werken met de OmpR regulator. - Bmoeyaert
- Kan je eventueel een stroomschema maken van wat er juist "gebeurt", want ik kan het schema maar moeilijk volgen (en ik denk dat ik de enige niet ben). - Bmoeyaert
 "
"