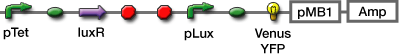Team:Chiba/Experiments:Reporter
From 2008.igem.org
| Home | The Team | The Project | Parts Submitted to the Registry | Reference | Notebook | Acknowledgements |
|---|
Reporter
本プロジェクトではある一定時間がたった時に、遺伝子発現が起こるタイマーを作ることが目的
レシーバーの遺伝子発現から確認までのタイムラグができるだけ少ない出力が必要
そこで候補となったのは、以下の3種類
- Fluorescent Protein
- Bioluminescence(luciferase)
- Cell staining (LacZ and X-gal assay)
蛍光たんぱくとβ-gal(lacZ)を実験で使用した。
蛍光たんぱくとしてGFP、maturationの早いVenus YFP[http://www.nature.com/nbt/journal/v20/n1/full/nbt0102-87.html|(1)],目視での確認が容易なmCherry[http://www.ncbi.nlm.nih.gov/pubmed/15558047|(2)],を選んだ。
Luciferaseは化学発光であるために、発現の確認には暗所でなければならない。使用条件が限られてしまうため候補から外した
Experiment
インダクションしてから、遺伝子発現が確認できるまでの時間を調べるために以下の遺伝子回路で、タイムレスポンスの評価を行った。
IPTGインダクションのものと、AHLインダクションのものを用意し、それぞれで評価した。
- Fluorescent Protein
- GFP
- Venus YFP
- mCherry
- β-gal (X-gal assay)
Result & Discussion
Result LacZ
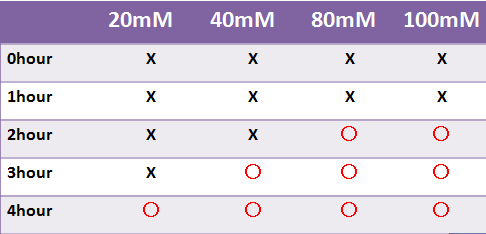
- 蛍光たんぱくではないLacZは目視のみで発現を確認した
- LacZはX-galの濃度によって目視での確認時間が変わった
- 液体で4時間以内に目視で確認することはできなかった
- -->8時間後目視で確認できた
蛍光たんぱく
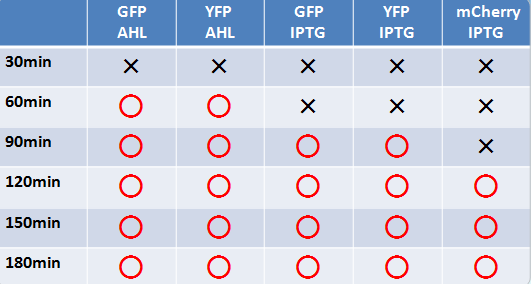
- 液体、固体培地において似たような結果になった
- 目視で一番見やさはmCherry,GFP,YFPの順であった
- 固体培地のほうが目視で確認しやすい
- AHLでのインダクションのほうがIPTGより確認できた時間が早かった
- GFP,YFPのほうがmCherryより確認できた時間が早かった
Discussion
このプロジェクトでは、発現するまでの時間を変えることが目的である
- X-galの濃度を高くすると発現を確認できるまでの時間は短くなったが、蛍光たんぱくで発現を確認できるまでの時間より遅い
- X-galを基質とするβ-galでは、時間がたつごとに基質濃度が下がり、出力までの時間が長くなってしまうことも考えられる
以上の2つの理由から蛍光タンパク質が適している
またGFP,YFPの発現時間までのタイムラグが一番少なかった
- 目視で確認した際、GFPのほうがYFPよりも目視で確認するのが容易であった
以上の理由から、出力はGFPとする。
Method
Strain:XL10G KanR
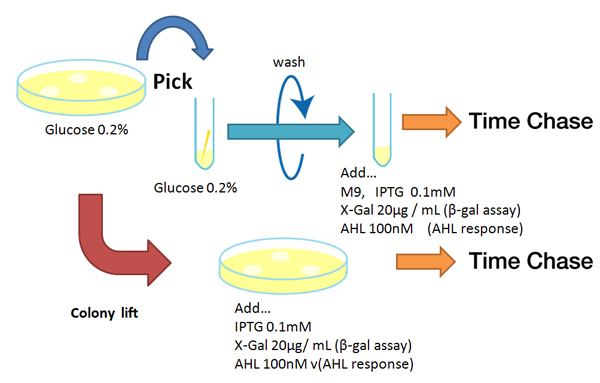
- Agar plate experiment
- Pre-culture
- Picked and cultured the following plate stocks in 2mL of LB:
- LB-Amp+0.2 % Glucose, (pGFPuv, pLac-Venus YFP, pLac-mCherry, pUC19)
- LB-Amp, ([http://partsregistry.org/Part:BBa_T9002 BBa_T9002], [http://partsregistry.org/Part:BBa_K084003 BBa_K084003])
- Cultured at 37°C for 12h.
- Picked and cultured the following plate stocks in 2mL of LB:
- Spread on plate
- Spread on new plate
- LB-Amp+0.2 % Glucose, (pGFPuv, pLac-Venus YFP, pLac-mCherry, pUC19)
- LB-Amp, ([http://partsregistry.org/Part:BBa_T9002 BBa_T9002], [http://partsregistry.org/Part:BBa_K084003 BBa_K084003])
- Cultured at 37°C for 12h.
- Spread on new plate
- Colony lift
- Colony lift to inducible agar plate (containing IPTG or AHL)
- LB-Amp+0.2 mM IPTG agar plate, (pGFPuv, pLac-Venus YFP, pLac-mCherry, pUC19)
- LB-Amp+100 nM AHL agar plate, ([http://partsregistry.org/Part:BBa_T9002 BBa_T9002], [http://partsregistry.org/Part:BBa_K084003 BBa_K084003])
- Incubate at 37 °C
- Colony lift to inducible agar plate (containing IPTG or AHL)
- Check expression every 30 min.
- Liquid medium experiment
- Pre-culture
- Picked and cultured the following plate in 2mL of LB:
- LB-Amp+0.2 % Glucose, (pGFPuv, pLac-Venus YFP, pLac-mCherry, pUC19)
- LB-Amp, ([http://partsregistry.org/Part:BBa_T9002 BBa_T9002], [http://partsregistry.org/Part:BBa_K084003 BBa_K084003])
- Cultured at 37°C for 12h.
- Picked and cultured the following plate in 2mL of LB:
- Culture
- Dilute pre-cultures and add to new LB medium.
- LB-Amp+0.2 % Glucose, (pGFPuv, pLac-Venus YFP, pLac-mCherry, pUC19)
- LB-Amp, ([http://partsregistry.org/Part:BBa_T9002 BBa_T9002], [http://partsregistry.org/Part:BBa_K084003 BBa_K084003])
- Cultured at 37°C for about 6 h
- Dilute pre-cultures and add to new LB medium.
- Wash
- Transfer 10mL each of the culture to 50mL centrifuge tubes.
- Centrifuged for 6min at 3600rpm,20°C and discarded the supernatant.
- Add physiological saline and resuspention
- Repeated wash twice.
- Add M9 minimal medium.
- Mix
- Dispens each culture into 48-well deep well or 96-well deep well
- Add IPTG fainal conc. 0.2 mM (pGFPuv, pLac-Venus YFP, pLac-mCherry, pUC19)
- Add AHL fainal conc. 100nM ([http://partsregistry.org/Part:BBa_T9002 BBa_T9002], [http://partsregistry.org/Part:BBa_K084003 BBa_K084003])
- Measure fluorescence intensity every 1 h.
- Equipment
- shaking incubator
- Innova 4200 Benchtop or Floor-Stackable Incubator Shaker(37°C)
- 46-well plate(deep well)
- 96-well plate(deep well)
- Fluoroskan Ascent 2.5(program:Ascent Software Version 2.6)
- Beckman Allegratm X-12R Centrifuga(Beckman Coulter)
- 固体編
固体培地(pLac:0.2%グルコース入り)にまく
コロニーを新しい固体培地(pLac:IPTG, plux:AHL, LacZ:IPTG&X-gal入り)にコロニーリフトする,計測開始
37°Cのしんとう培養器で培養
30分ごとに目視で確認できるか観察
- 液体編
プレ培
コロニーを固体培地からピックし,LB培養液2ml(pLacであれば0.2%グルコース入り)で12時間培養(37°C)
本培
OD値を計測して、菌数を合わせるため培養液を1/200に希釈する。
OD=1.00になるまで37°Cで培養
生理食塩水で洗浄(2.0min 8,000rpm)x2
46穴または96穴deep wellにM9(2ml)
IPTG(最終濃度0.1mM)またはAHL(最終濃度100nM)を加えて、計測開始
30分ごとに蛍光強度、OD値を計測、また目視で確認できるか観察
| Home | The Team | The Project | Parts Submitted to the Registry | Reference | Notebook | Acknowledgements |
|---|
 "
"