Team:Chiba/Project
From 2008.igem.org
| Home | The Team | The Project | Parts Submitted to the Registry | Reference | Notebook | Acknowledgements |
|---|
Abstract
- "Team : Chiba - E.coli time manager"
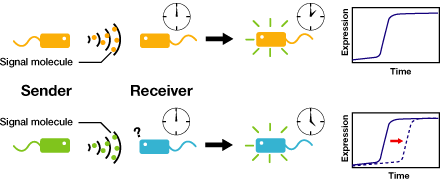
We control the timing of gene expression by using multiple signaling devices.To this end,we utilize molecules associated with Quorum sensing, a phenomenon that allows bacteria to communicate with each other.Our project uses two classes of bacteria: senders and receivers. Senders produce signaling molecules, and Receivers are activated only after a particular concentration of this molecule is reached.Although different quorum sensing species have slightly different signaling molecules, these molecules are not completely specific to their hosts and cross-species reactivity is observed [http://www3.interscience.wiley.com/journal/119124142/abstract (1)],[http://partsregistry.org/Part:BBa_F2620:Specificity (2)]. Communication using non-endogenous molecules is less sensitive, and requires a higher signal concentration to take effect.This results in slower activation of receivers.
Introduction
「タイマー」は私たちの生活を便利にする非常に優れた装置であり、様々な場所で利用されている。
例えば、キッチンタイマーや電子レンジなどにもタイマーが使われている。キッチンタイマーは、設定された時間が経つと音を鳴らして私たちに知らせるという機能を持つ。電子レンジは温めるという行為と平行して時間の測定を行い、一定時間が経つとその行為を終了させるという機能を持つ。
このタイマーという便利な機能を生物にも導入できないだろうか。タイマーを生物システムに組み込めば、生体機能を時間的に制御することができると私たちは考えた。Chibaの"E.coli Time Manager"は、蓄積を利用したタイマーシステムだ。詳しくはプロジェクトデザインで説明する。私たちはこの"E.coli Time Managar"を使うことで以下のようなシステム作成が可能になると考えている。
1つめはセキュリティーシステムだ。
測定時間の違う複数のタイマーを同時に起動させれば、決まった順序で自動的に遺伝子発現をおこすことができる。これによって順々に文字を浮き上がらせたり、消し去ったりすることで情報漏洩を防ぐことができる。
2つめは賞味期限装置。
今までの賞味期限は規定された保存状態でどれだけの時間、食品の安全が保証されるのかというものだった。食品がある一定温度にどれだけ放置されたかを計ることで、それに対する菌の活性の経緯知ることが出来る。これが出来ればより本質に近い賞味期限を提示することができるだろう。
3つめは積分装置。
例えばUVを入力としたとする。UVは揮発的な入力であるが、私たちのシステムはその入力を蓄積によって記憶する。これによって被爆計や、揮発性汚染の警告装置を作ることが出来るだろう。
Our project
従来:消えていく物質の存在時間によって時間調節する。Missouri Miners 2007 "A biological timer"
千葉:常に物質が一定の割合で蓄積されるとき、ある閾値超えるまでの時間調節する。
調節する方法には、二つが挙げられる。
- 蓄積するときの割合を変える。
- 閾値自体を変える。
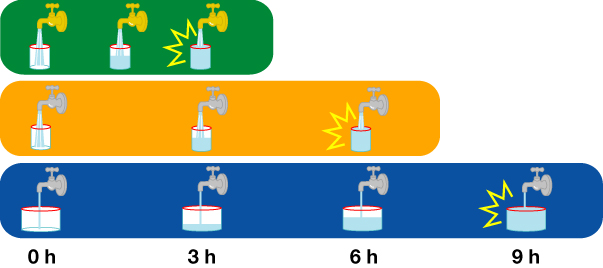
- 右の絵は一定の割合で水がある容器の中にたまっていく様子を示している。
- ここでは、容器に水がたまることった時が閾値を超えた時とする
- 一番上は蓄積するスピードが速く、容器が小さいのでたまる時間は短い
- 真ん中は蓄積する容器は小さいが、蓄積するスピードが遅いためにたまる時間は遅くなる
- 一番下は蓄積するスピードが遅く、容器が大きいためにたまる時間がより遅くなる
System design
1、全体の説明
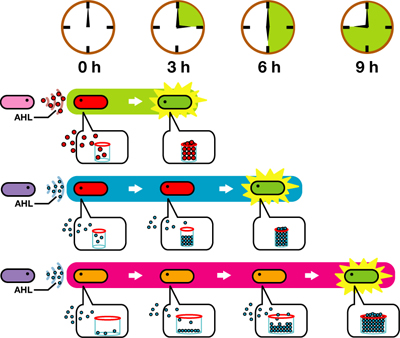
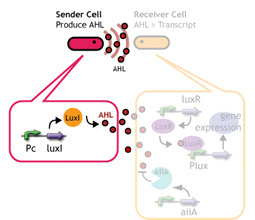
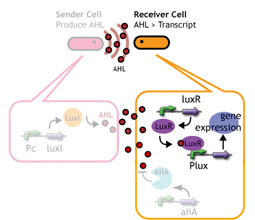
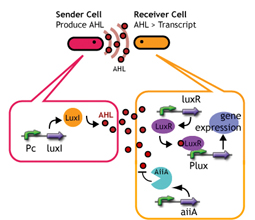
蓄積したシグナル分子によって遺伝子発現が起こる細胞間コミュニケーションであるクオラムセンシングを利用する。
クオラムセンシングではLuxI protein familyがシグナル分子であるAHLを合成する。
LuxR protein familyはAHLに応答し、Lux promoter下の遺伝子を発現する。
LuxI protein familyによって合成されたAHLを蓄積していく->ある点(応答閾値)まで蓄積すると、遺伝子発現が起こる
合成されたAHLが応答閾値に達するまでの時間を変えることで、遺伝子発現までの時間を調整することができる。
応答閾値までAHLが蓄積すると、GFPを発現する
その蛍光強度によって遺伝子発現を調べる
2、How to control the timing of gene expression
|
|
|
Quorum Sensing Cross-talk
クオラムセンシングにおける送受信装置は由来する生物ごとに特有のセットをなしているが、異種の送受信装置同士もCross-talkすることが分かっている。 Cross-talkによるコミュニケーションは感度が鈍いため、Receiverの活性化が遅くなる。
more about Quorum Sensing Cross-talk
Experiments and Result
Signal Molecule Sender Phase
Design
Utilize Quorum Sensing Cross-talk
English:Each species has their own LuxI-type proteins,which synthesize their specific autoinducers,AHLs.AHLs produced by different LuxI-type proteins differ only in the length of the acyl-chain moiety and substitution at position C-3.LuxR,which is original for Vibrio fischeri,is activated by its cognate autoinducer,3OC6HSL.However,LuxR is also activated by non-endogenous molecules,C4HSL,C6HSL,and 3OC12HSL.Activation by non-endogenous molecules requires a higher signal concentration[http://partsregistry.org/Part:BBa_F2620:Specificity (2)].This results in slower activation of receivers,when AHL concentration is increasing.日本語:異なる生物はそれぞれに異なるLuxIタイプのタンパク質を持ち、アシル鎖の長さ、あるいはC-3位の置換基が異なる種類のAHLを合成する。それぞれの生物種のLuxIタイプのタンパク質、それが合成する分子名は以下の表のようである。 (Fig.4).AHLを受け取り応答するLuxRタンパク質はVibrio fischeri由来であり、3OC6HSLに応答する。しかし、他種生物由来のAHLにも応答することが知られており、このとき、より高い濃度のAHLが必要となる[http://partsregistry.org/Part:BBa_F2620:Specificity (2)].AHLがゆっくり溜まっていく時、LuxRは3OC6HSLに対して最も早く応答し、他のAHLに対してはそれよりも遅く応答する。 (冨永)
more about AHL sender phase design
Result
Crosstalk test
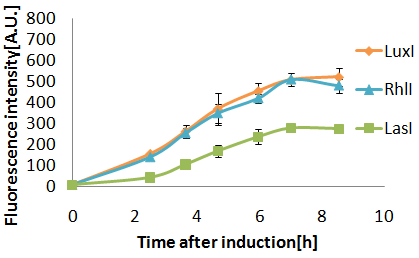
- RhlIとLuxIでは、GFP inductionにかかる時間はほとんど同じであった.
- LasIは、GFP inductionが他より約2時間遅れた.
(冨永)
more about Sender experiment and result
Signal Molecule Receiver Phase
English:
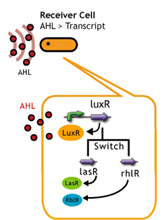
日本語:AHLを合成するSenderだけではなく、AHLを受け取る側のReceiverを変えれば、その応答時間を変えることができる。そこで私たちは、以下のいくつかの方法を考えた。
- 一種類のSender(AHL<--LuxI)に対して、由来生物の異なるレシーバタンパク質でそれを受信する.
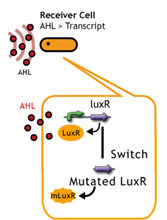
- レシーバータンパク質であるLuxRに変異を入れることで、AHLに対する応答感度を上下させること.
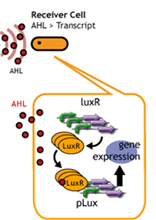
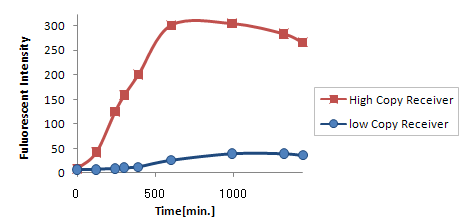
- レシーバーのコピーナンバーを変える.
Quorum-Sensing Crosstalkクオラムセンシングにおける、レシーバータンパクを変えてクロストークを起こさせる。 |
Plasmid Copynumber遺伝子回路を含むプラスミドをもったレシーバーのコピーナンバーを変えることで、応答までの時間を変える
|
|
LuxR mutant (Under construction)
レシーバータンパク質であるLuxRに変異を入れることで応答感度を上下させる
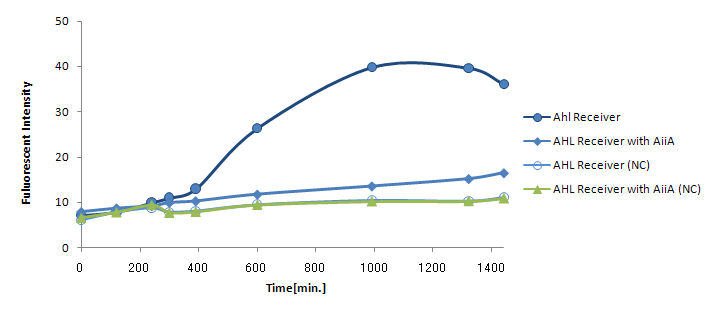
Signal Molecule Quencher
Design
|
more about AiiA Receiver Phase |
more about AiiA Receiver Experiment |
Demo Experiments
実験内容とdataかるく
Demo experiments detail
English:
日本語:
固体培地中にセンダー(LuxI)を混ぜ、固体培地表面にレシーバーのコロニーをN.Cフィルターで移す。
センダーの作るAHLは培地中を移動し、表面のレシーバーがAHLを一定濃度感知すればGFPを発現
する。一種のセンダーに対し、様々なレシーバーを用いることで時間差が生じることを確認する。
用いるレシーバーは具体的に・・・
・シグナルを受け取るレシーバーを変える(クロストークの利用)
・シグナル自体を分解するAiia を利用する
・レシーバーの遺伝子回路を含むプラスミドのコピーナンバーの変化
・レシーバータンパク質であるLuxRに変異を入れる
・確認の仕方
37℃で培養しているreceiverに時間(30min?)ごとにUVをあててGFPが見えるかチェックする。
香取
Conclusion
Signal Molecule Sender phase
目視実験
- 蛍光強度150~200で、肉眼でGFPを確認することができる。
Senders(BW),T9002(BW)@37
菌数μL、Sender:Receiver=500:500,100:1000,10:1000
- CinI+LVAとLuxRのクロストークはどの菌数比でもおこらない。
- RhlIが(RhlI+LVA、LasI、CinI+LVAの中で)一番クロストークする。
- Sender同士のクロストークの時差(蛍光強度200に達するまでの時間)は、1時間以下の範囲でしか発生しなかった。
Senders(BW),T9002(BW)@30
- 特に37℃で行ったときと差はない
- BWはクオラムセンシングをしやすい株なので、Senderを変えてもたいした時差が見られなかった。
- 次回からはSender側の株をXL10Gに代えて実験を行う。
Senders(XL10G),T9002(BW)@37
- SenderをBW株にして行った実験よりも、8時間後の蛍光強度が平均で200くらい落ちた。
- この条件ではLasIのクロストークは起こりにくい。
- (8h後の最終蛍光強度(菌比1:1)、LasI:LuxI(Ptet):RhlI:RhlI+LVA=163:267:394:325)
Senders(XL10G),T9002(BW)@30
- 37℃で行った実験と比べ、LasIが活性。(8h後の蛍光強度、37℃:30℃=163:245)
- LasとLux(Plac)1:1で蛍光強度200に達するまでの時間に2.5時間の時差がみられた。
- Rhlのタグなしとタグ付きの差は、8h後の最終強度にしか現れなかった。
- また、差が一番でたのが30℃で行ったこの実験で、タグなし:タグつき=507:456。
Senders(XL10G),T9002(BW)@RT(25℃)
- どのSenderもGFP強度20~50の範囲。ネガコン(T9002のみ)の値、40前後と変わらず。
(ただし、静置培養のため、しんとう培養した30℃や37℃とは条件が違う。)
--Yoshimi 05:03, 29 October 2008 (UTC)
Signal Molecule Receiver phase
Cross talk
クロストークさせると、発現量が大きく減少してしまうのでタイムラグを確認できるほど遺伝子が発現がGFPでは確認できなかった
LuxR以外のR protein familyには分解タグである,LVA tagがついていたので、もともと発現しにくいもの[http://www3.interscience.wiley.com/journal/119124142/abstract (1)]が、さらに発現が見えにくくなったと考えられる
Copy Number
コピーナンバーを変えても、発現量が大きく減少してしまう。
最終的な発現量が同じで、応答閾値の濃度が低くなるような変異LuxRを発現させることがレシーバーを変えてtime delayを起こすことに一番適している(?)
Signal Molecule Quencher phase
Future Work
references
- [http://www3.interscience.wiley.com/journal/119124142/abstract M.K Winson et al.:Construction and analysis of luxCDABE-based plasmid sensors for investigating N-acyl homoserine lactone-mediated quorum sensing.FEMS Microbiology Letters 163 (1998) 185-192]
- [http://partsregistry.org/Part:BBa_F2620:Specificity BBa_F2620:Specificity]
- [http://authors.library.caltech.edu/5553/ C. H. Collins.et al.:Directed evolution of Vibrio fischeri LuxR for increased sensitivity to a broad spectrum of acyl-homoserine lactones.Mol.Microbiol.2005.55(3).712–723]
- [http://mic.sgmjournals.org/cgi/content/abstract/151/11/3589 B. Koch. et al.:The LuxR receptor: the sites of interaction with quorum-sensing signals and inhibitors.Microbiology 151 (2005),3589-3602]
| Home | The Team | The Project | Parts Submitted to the Registry | Reference | Notebook | Acknowledgements |
|---|
 "
"