Team:Chiba/Experiments:copy number
From 2008.igem.org
| Home | The Team | The Project | Parts Submitted to the Registry | Reference | Notebook | Acknowledgements |
|---|
Copy number of Receiver Plasmid
Design
レシーバーのコピーナンバーを変えることで、応答までの時間を変える
コピーナンバーを変えれば、レシーバーによるLuxRの合成量は変化する
AHLを受け取るLuxRが変わるので応答閾値までの時間が変わると考えた
Experiment
oriがcolE1のハイコピーベクターにのったBBa_T9002と、oriがP15Aのローコピーベクターに乗ったT9002バリエーションを使用した。
これらを比較することでコピーナンバーを変えることでの影響を調べた。
以下の遺伝子回路を使って、実験を行った。
|
|
| **[http://partsregistry.org/Part:BBa_S03623 BBa_S03623 (AHL autoinucer)] |
|
|
これらのほかにBBa_T9002にはChloramphenicol耐性マーカーを持つ空ベクター、Low copyバリエーションにはAmpicillin耐性マーカーの空ベクターをダブルトランスフォーメーションさせた。
Method
- Transformed sender(Ptet-LuxI), high copy receiver(Ptet-LuxR-Plux-GFP-colE1) and Medium copy receiver(Ptet-LuxR-Plux-GFP-p15A) respectively into E coli strains(BD⊿FliC).
- Inoculated them independently in liquid media. Incubated at 37°C 12h.
- Inoculated again in Fresh liquid media upto about OD600=2 at 37°C
- Washed sender and receivers.
- Mixed them. (Sender:Receiver=1000μL:1000μL)
- Incubated at 30°C.
- Measured intensity of green fluorescence at regular time intervals.(Fluoroskan AscentR FL&Fluoroskan AscentR Thermo ELECTRON CORPORATION)
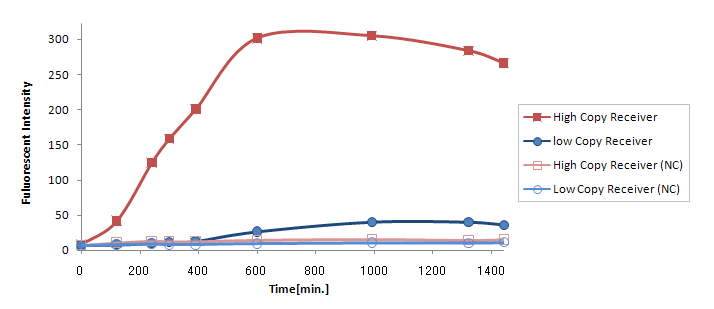
Result & Discussion
(Ptet-LuxR-plux-GFP-colE1)の発言量に比べて(Ptet-LuxR-pLux-GFP-p15A)の発現量は大きく減少してしまった。
この理由は
- GFPがローコピーのベクターに乗っていたので発現量が落ちた。
- LuxRの合成量が少なすぎる。
が考えられるが、(Ptet-luxR-p15A + plux-GFP-colE1)と(Ptet-LuxR-pLux-GFP-colE1)ではまったく同じTrasnfor Carveの軌跡を描いた。(Data is not shown) このことより、p15Aのベクターに乗ったLuxRの発現量は、ハイコピーのベクターに乗ったpLuxを活性化するのに十分な量であると考えられる。 したがって理由1が有力である。 (小林)
 "
"