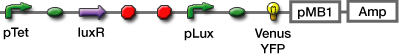Team:Chiba/Experiments:Reporter
From 2008.igem.org
(Difference between revisions)
(→Method) |
|||
| Line 55: | Line 55: | ||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
==Result & Discussion== | ==Result & Discussion== | ||
Revision as of 02:47, 30 October 2008
| Home | The Team | The Project | Parts Submitted to the Registry | Reference | Notebook | Acknowledgements |
|---|
Reporter
本プロジェクトではある一定時間がたった時に、遺伝子発現が起こるタイマーを作ることが目的
レシーバーの遺伝子発現から確認までのタイムラグができるだけ少ない出力が必要
そこで候補となったのは、以下の3種類
- Fluorescent Protein
- Bioluminescence(luciferase)
- Cell staining (LacZ and X-gal assay)
蛍光たんぱくとβ-gal(lacZ)を実験で使用した。
蛍光たんぱくとしてGFP、maturationの早いVenus YFP[1],目視での確認が容易なmCherry[2],を選んだ。
Luciferaseは化学発光であるために、発現の確認には暗所でなければならない。使用条件が限られてしまうため候補から外した
Experiment
インダクションしてから、遺伝子発現が確認できるまでの時間を調べるために以下の遺伝子回路で、タイムレスポンスの評価を行った。
IPTGインダクションのものと、AHLインダクションのものを用意し、それぞれで評価した。
- Fluorescent Protein
- β-gal (X-gal assay)
Result & Discussion
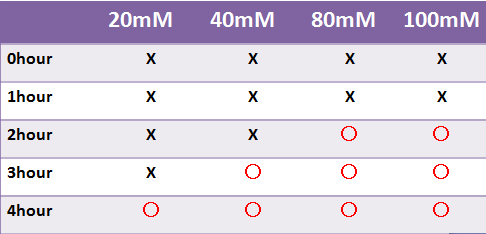
Result LacZ
- 蛍光たんぱくではないLacZは目視のみで発現を確認した
- LacZはX-galの濃度によって目視での確認時間が変わった
- 液体で4時間以内に目視で確認することはできなかった
- -->8時間後目視で確認できた
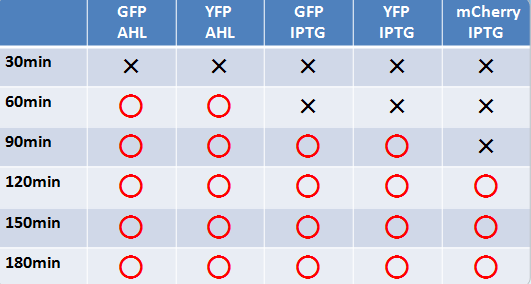
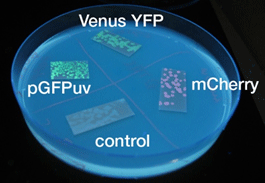
蛍光たんぱく
- 液体、固体培地において似たような結果になった
- 目視で一番見やさはmCherry,GFP,YFPの順であった
- 固体培地のほうが目視で確認しやすい
- AHLでのインダクションのほうがIPTGより確認できた時間が早かった
- GFP,YFPのほうがmCherryより確認できた時間が早かった
Discussion
このプロジェクトでは、発現するまでの時間を変えることが目的である
- X-galの濃度を高くすると発現を確認できるまでの時間は短くなったが、蛍光たんぱくで発現を確認できるまでの時間より遅い
- X-galを基質とするβ-galでは、時間がたつごとに基質濃度が下がり、出力までの時間が長くなってしまうことも考えられる
以上の2つの理由から蛍光タンパク質が適している
またGFP,YFPの発現時間までのタイムラグが一番少なかった
- 目視で確認した際、GFPのほうがYFPよりも目視で確認するのが容易であった
以上の理由から、出力はGFPとする。
| Home | The Team | The Project | Parts Submitted to the Registry | Reference | Notebook | Acknowledgements |
|---|
 "
"