Team:Chiba/Calendar-Home/2 September 2008
From 2008.igem.org
1 September 2008 <|> 3 September 2008
Contents |
Laboratory work
Team:Input
UV照射実験
- Ptet,Ptet-RFP,PrecA-RFPのグリストをつついて2ml培養(LB-Amp)
- 37℃,12h後,ODを測定して102~103のコロニーができるようにプレートに撒く。Ptet×1(コントロール用),Ptet-RFP×1(コントロール用),Prec-RFP×3(コントロール用×1,UV照射用×2)
- 新たなAmpプレート8枚(2.5cm,6.5cmのそれぞれ30sec,1min,30min,1h用)に、撒いて37℃,12hたったコントロール用のPtet,Ptet-RFPのコロニーをニトロセルロースでうつしてはる。
- PrecA-RFPのプレートにUVを照射する。UVからの距離は2.5cmと,6.5cmの2パターンで実験する。Prec-RFPのコントロール用は暗所に置いておく。
- UV照射後30sec,1min,30min,1h経過したらそれぞれ(2.5cmでUV当てたもの、6.5cmでUV当てたもの、コントロール用)のプレートからニトロセルロースでコロニーをうつしとり、あらかじめコントロールをはっておいたAmpプレートにはりつけた。
- それぞれのプレートでUVが照射されてからどのくらいの時間でRFPが発現するのかを調べるためにUV照射してから、0min,10min,30min,1h,2h,3h,4h,5h,6h後にスキャナーで取り込んで色の変化を見る。
- 結果
- PrecA-RFPにUVを当てたものはいづれもRFPが目で確認できなかった。
Team:Communication
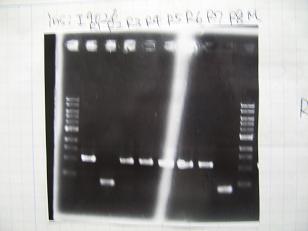
- (31/8)--->Gel Check
|
|
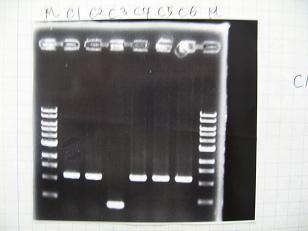
- (1/9)---> Colony PCR
- Colony PCR of 8 colonies from ligation plates (1/9:(1)[http://partsregistry.org/Part:BBa_K084009 BBa_K084009](R1~R8),(2)[http://partsregistry.org/Part:BBa_K084010 BBa_K084010](C1~C8)) and one from control plate([http://partsregistry.org/Part:BBa_F2620 BBa_F2620](2007)).
DNA Template 1 dNTP mix 5 Foward Primer 0.3 Reverse Primer 0.3 DNA polymerase TAQ 0.5 Thermopol Buffer 3 dH2O 20.5 TOTAL 30μL
- 95℃,5min -> ( 95℃,1min -> 52℃,1min -> 72℃,1min )・・・25cycles -> 72℃,10min -> 6℃
--->Gel CheckSample DNA 1 Loading Dye 1 dH2O 4 TOTAL 6 - From left;
- Plac+RBS+RhlI+LVA
- R1 -> OK
- R2 -> Bad
- R3~R7 -> OK
- R8 -> Bad
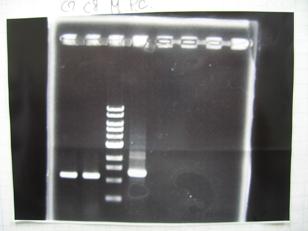
- From left;
- From left;
- Plac+RBS+CinI+LVA
- C1,C2 -> OK
- C3 -> Bad
- C4~C6 -> OK
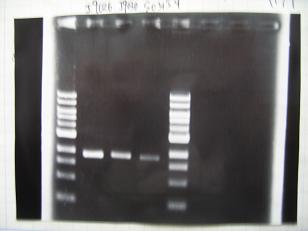
- From left;
- Plac+RBS+CinI+LVA
- C7,C8 -> OK
- [http://partsregistry.org/Part:BBa_F2620 BBa_F2620](2007):Positive control -> OK
- --->(3/9)Mini prep
(1/9)--->Liquid Culture- Cultured the following cells (2mL LB-Amp, at 37℃, 7 hours)
- from transformed plates:
- [http://partsregistry.org/Part:BBa_K084007 BBa_K084007](Plac+RBS+LasI, Competent Cells : JW1908)
- [http://partsregistry.org/Part:BBa_K084008 BBa_K084008](Plac+RBS+RhlI, Competent Cells : JW1908)
- [http://partsregistry.org/Part:BBa_T9002 BBa_T9002](Ptet+RBS+LuxR+GFP, Competent Cells : JW1908)
- from Glycerol Stock:
- [http://partsregistry.org/Part:BBa_S03623 BBa_S03623](Ptet+RBS+LuxI, Competent Cells : JW1908)
- from transformed plates:
--->(3/9)Phenotype test
- Competent cells : XL10G 30μL
- [http://partsregistry.org/Part:BBa_C0161 BBa_C0161](2007)
- [http://partsregistry.org/Part:BBa_C0161 BBa_C0161](2006)
- [http://partsregistry.org/Part:BBa_C0261 BBa_C0261](2007)
- [http://partsregistry.org/Part:BBa_C0261 BBa_C0261](2006)
--->(4/9)Mini prep
Team:Output
Colony PCR
- [http://partsregistry.org/Part:BBa_R0010 BBa_R0010]+[http://partsregistry.org/Part:BBa_J52008 BBa_J52008]
Sample No. ① culture 1 Fwd primer 1.5 Rev primer 1.5 Thermo pol Buffer 3 dNTP mix 3 Taq DNA pol (NEB) 0.2(1 unit) dH2O 19.8 TOTAL 30μl - [http://partsregistry.org/Part:BBa_R0079 BBa_R0079]
- [http://partsregistry.org/Part:BBa_R0071 BBa_R0071]
- [http://partsregistry.org/Part:BBa_R0077 BBa_R0077]
- [http://partsregistry.org/Part:BBa_R0078 BBa_R0078]
- [http://partsregistry.org/Part:BBa_R0062 BBa_R0062]
 "
"