Team:Chiba/Project/Experiments:Receiver Crosstalk
From 2008.igem.org
(→Design) |
(→Design) |
||
| Line 33: | Line 33: | ||
| - | + | In addition, LuxR protein family activates the expression of gene which is located under a unique sequences of so-called Lux box promotor.(Fig. )<br> | |
| - | Lux | + | Strictly speaking, the sequences of Lux box are dependent of the species of bacteria, however, they are quie similar so that we aim the gene expression of endo-geneous LuxR protein family with AHL. |
<br clear=all> | <br clear=all> | ||
Revision as of 23:14, 29 October 2008
| Home | The Team | The Project | Parts Submitted to the Registry | Reference | Notebook | Acknowledgements |
|---|
Receiver Cross-talk
Design
|
|
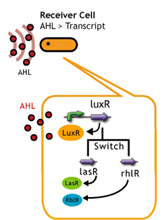
In this plan, we induce cross-talk of quorum sensing by changing receiver protein. It is known that receiver proteins can work with the stimuli of signaling molecule even from another species of bacteria (See table).(1)(2)。
These endo-genieous combination of signaling molecules and receiver proteins causes the delay of response time and as a result the gene expression triggered by quorum sensing device is to be delayed.
Fpr instance, receiver proteins, RhlR and LasR (from Pseudomonas aeruginosa) is stimulized by 3OC6HSL.
In addition, LuxR protein family activates the expression of gene which is located under a unique sequences of so-called Lux box promotor.(Fig. )
Strictly speaking, the sequences of Lux box are dependent of the species of bacteria, however, they are quie similar so that we aim the gene expression of endo-geneous LuxR protein family with AHL.
Experiment
LuxR protein familyを変えてクロストークさせる実験を行った。
AHL senderとしてVibrio fischeri由来のLuxIを常に発現させ、3OC6HSLを合成させる。
AHL ReceiverとしてLuxR protein familyを発現させるReceiver plasmidと,Lux promoter下にGFPを含むレポータープラスミドをダブルトランスフォーメーションさせた。
AHL senderによって合成されたAHLをAHL receiverが受取り、Lux promoter下のGFPが発現する。
蛍光強度を蛍光リーダーを使ってGFPの発現を計測し、遺伝子発現の活性を調べた。
使った遺伝子回路は以下の通りある。
|
|
|
|
|
|
| ||
| ||
|
Method
- Transformed Sender into E.coli strains(BWΔFliC) and Receivers into E.coli strain(BWΔFliC).
- Inoculated them independently in liquid media. Incubated at 37c°; 12h.
- Inoculated again at 37c°; upto about OD600=2.0
- Washed them.
- Mixed them (Sender:Receiver=1000μl:1000μl).
- Incubated at 30°C.
- Measured intensity of green fluorescence at regular time intervals.
Result & Discussion
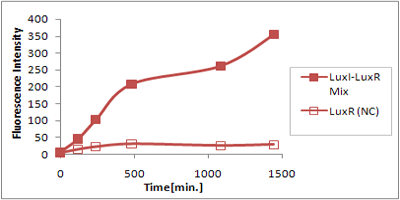
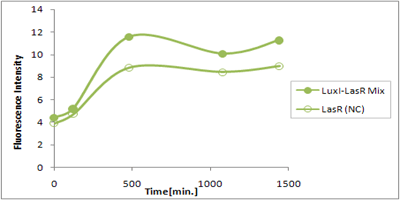
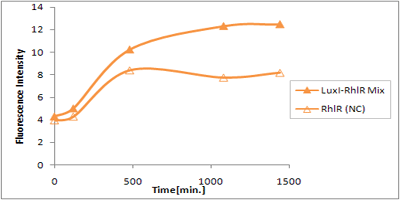
さまざまなLux protein familyを発現させ、AHLによって発現が誘導されたGFPの蛍光強度を測定した結果が上のグラフ
LuxRを発現させたとき、GFPは多く発現していることが分かる(Fig.X-A)が、そのほかのLasR,RhlRを発現させた場合、ほとんど蛍光強度が上昇していない。(Fig.X-B,Fig.X-C)
つまり、遺伝子発現が活性化されていることが確認できなかった。
クロストークさせると、発現量が大きく減少してしまうのでタイムラグを確認できるほど遺伝子が発現がGFPでは確認できなかった
本実験では、LuxR以外のR protein familyには分解タグである,LVA tagがついていた。 LuxI->LasR->PLas,LuxI->RhlR->PRhlは元来発現強度が弱いので[http://www3.interscience.wiley.com/journal/119124142/abstract (1)]、LVAの影響により、さらに発現が見えにくくなったと考えられる。
よってLasRとRhlRのLVAをとり、Sender:LuxI, Receiver:LuxR,LasR,RhlRのクロストーク評価を行う必要がある。
Demo ~Receivers~
English:
日本語:
固体培地中にセンダー[http://partsregistry.org/Part:BBa_S03623 BBa_S03623],(Ptet-LuxI) を混ぜ、固体培地表面にレシーバーのコロニーをN.Cフィルターで移す。
センダーの作るAHLは培地中を移動し、表面のレシーバーがAHLを一定濃度感知すればGFPを発現
する。一種のセンダーに対し、様々な種類のレシーバーを用いることで時間差が生じることを確認する。
用いるレシーバーは・・・
・シグナル自体を分解するAiia を利用する
・レシーバーの遺伝子回路を含むプラスミドのコピーナンバーの変化
・レシーバータンパク質であるLuxRに変異を入れる
・確認の仕方
N.Cフィルターをはった個体培地を37°Cで培養し、時間(30min?)ごとにUVをあててGFPが見えるかチェックする。
香取
Results
--->more about Demo experiments detail
--->more about Demo experiments detail
Reference
- [http://www3.interscience.wiley.com/journal/119124142/abstract M.K Winson et al.:Construction and analysis of luxCDABE-based plasmid sensors for investigating N-acyl homoserine lactone-mediated quorum sensing.FEMS Microbiology Letters 163 (1998) 185-192]
- [http://partsregistry.org/Part:BBa_F2620:Specificity BBa_F2620:Specificity]
| Home | The Team | The Project | Parts Submitted to the Registry | Reference | Notebook | Acknowledgements |
|---|
 "
"