Team:Chiba/Project/Experiments:Sender Crosstalk
From 2008.igem.org
(→references) |
(→Details) |
||
| Line 71: | Line 71: | ||
#Positive Feedback Loopを導入する. | #Positive Feedback Loopを導入する. | ||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
===Other Experiments=== | ===Other Experiments=== | ||
Revision as of 23:53, 29 October 2008
| Home | The Team | The Project | Parts Submitted to the Registry | Reference | Notebook | Acknowledgements |
|---|
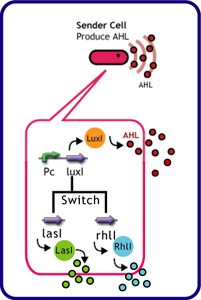
Sender Crosstalk
Design
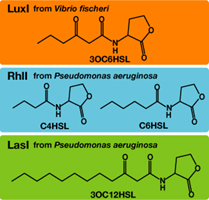
Each species has their own LuxI-type proteins,which synthesize their specific autoinducers,AHLs.AHLs produced by different LuxI-type proteins differ only in the length of the acyl-chain moiety and substitution at position C-3.LuxR,which is original for Vibrio fischeri,is activated by its cognate autoinducer,3OC6HSL.However,LuxR is also activated by non-endogenous molecules,C4HSL,C6HSL,and 3OC12HSL.Activation by non-endogenous molecules requires a higher signal concentration(2).This results in slower activation of receivers,when AHL concentration is increasing.
異なる生物はそれぞれに異なるLuxIタイプのタンパク質を持ち、アシル鎖の長さ、あるいはC-3位の置換基が異なる種類のAHLを合成する。それぞれの生物種のLuxIタイプのタンパク質、それが合成する分子名は以下の表のようである。 (Fig.4).AHLを受け取り応答するLuxRタンパク質はVibrio fischeri由来であり、3OC6HSLに応答する。しかし、他種生物由来のAHLにも応答することが知られており、このとき、より高い濃度のAHLが必要となる(1),(2).AHLがゆっくり溜まっていく時、LuxRは3OC6HSLに対して最も早く応答し、他のAHLに対してはそれよりも遅く応答する。 (冨永)
Experiments
センダーの違いによるディレイをみることをめざし,次の表に示すセンダーとレシーバを別々の液体LB培地で培養@37°C,12h後(stationaryに達したら?対数増殖機の細胞の分裂によるsender量増加を防ぐため?),それぞれを混ぜ,30°Cで培養し,一定時間ごとのgfp蛍光強度(485nm(excitation) and 527nm(emission))を測定した。(詳しくはページしたのdetailsへ)
| senders (cell: XL10-Gold or JW1908) | receiver (cell: JW1908) |
| *[http://partsregistry.org/Part:BBa_K084007 plac+rbs+LasI] (pSB1AK3) | *[http://partsregistry.org/Part:BBa_T9002 BBa_T9002 (Express GFP in response to AHL)] (pSB1A3) |
| *[http://partsregistry.org/Part:BBa_K084008 plac+rbs+RhlI] (pSB1AK3) | |
| *[http://partsregistry.org/Part:BBa_K084009 BBa_K084009] | |
| *[http://partsregistry.org/Part:BBa_K084012 plac+rbs+LuxI] (pSB1AK3) | |
| *[http://partsregistry.org/Part:BBa_K084014 BBa_K084014] | |
| *[http://partsregistry.org/Part:BBa_S03623 BBa_S03623(ptet+rbs+LuxI(LVA))] |
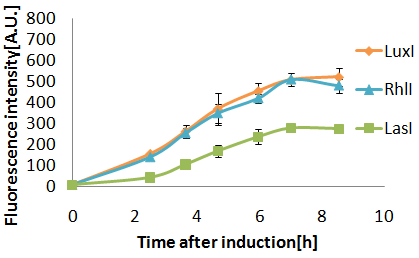
Results & Discussion
Senders(XL10Gold),T9002(JW1908)@30°C菌数(μL)、Sender:Receiver=500:500,100:1000,10:1000
- 37°Cで行った実験と比べ、LasIが活性。(8h後の蛍光強度、37°C:30°C=163:245)
- LasとLux(Plac)1:1で蛍光強度200に達するまでの時間に2.5時間の時差がみられた。
- Rhlのタグなしとタグ付きの差は、8h後の最終強度にしか現れなかった。
- また、差が一番でたのが30°Cで行ったこの実験で、タグなし:タグつき=507:456。
3OC6HSL,3OC12HSLに対する、LuxRの応答時間に、二時間の差ができた(3OC12HSLの場合、3OC6HSLに比べて二時間遅れて応答する)。 (そのときの条件は、培養温度30°C、genelatorの株はXL10Gold,Receiverの株はJW1908のとき、であった。) <??
Future plans
- AHL合成酵素の発現量を減らし,AHL生産速度を遅くする.
- RBSをweakにする。
- コピーナンバーをlowにする.
- transfer curveをシグモイダルに近づける.
- Positive Feedback Loopを導入する.
Other Experiments
目視実験
- 試験管内の培養液(2mL)が、緑色を呈しているときの蛍光強度:150~200。
--Masahiro 07:16, 29 October 2008 (UTC)
Senders(JW1908),T9002(JW1908)@37°C菌数(μL)、Sender:Receiver=500:500,100:1000,10:1000
- CinI+LVAとLuxRのクロストークはどの菌数比でもおこらない。
- RhlIが(RhlI+LVA、LasI、CinI+LVAの中で)一番クロストークする。
- Sender同士のクロストークの時差(蛍光強度200に達するまでの時間)は、1時間以下の範囲でしか発生しなかった。
Senders(JW1908),T9002(JW1908)@30°C菌数(μL)、Sender:Receiver=500:500,100:1000,10:1000
- 特に37°Cで行ったときと差はない
- BWはクオラムセンシングをしやすい株なので、Senderを変えてもたいした時差が見られなかった。
- 次回からはSender側の株をXL10Gに代えて実験を行う。
Senders(XL10Gold),T9002(JW1908)@37°C菌数(μL)、Sender:Receiver=500:500,100:1000,10:1000
- SenderをBW株にして行った実験よりも、8時間後の蛍光強度が平均で200くらい落ちた。
- この条件ではLasIのクロストークは起こりにくい。
- (8h後の最終蛍光強度(菌比1:1)、LasI:LuxI(Ptet):RhlI:RhlI+LVA=163:267:394:325)
Senders(XL10Gold),T9002(JW1908)@25°C菌数(μL)、Sender:Receiver=500:500,100:1000,10:1000
- どのSenderもGFP強度20~50の範囲。ネガコン(T9002のみ)の値、40前後と変わらず。
(ただし、静置培養のため、しんとう培養した30°Cや37°Cとは条件が違う。)
Demo ~Senders~
一番時差が見られたSender遺伝子のLuxIとLasIをつかってデモ実験を行った。
LuxIおよびLasIの遺伝子がそれぞれ組み込まれた大腸菌(XL10G)と、
LuxRの遺伝子が組み込まれた大腸菌(BW)を液体培養したものを 液量1:1で混ぜて、それらのGFPが発現するのを目視で観測した。
Results

Green region: sender=LuxI (100 uL), Red circular region: sender=Las I (100uL).
Receiver=LuxR (???? uL)
--toyota
-->more about Demo experiments detail
references
- [http://www3.interscience.wiley.com/journal/119124142/abstract M.K Winson et al.:Construction and analysis of luxCDABE-based plasmid sensors for investigating N-acyl homoserine lactone-mediated quorum sensing.FEMS Microbiology Letters 163 (1998) 185-192]
- [http://partsregistry.org/Part:BBa_F2620:Specificity BBa_F2620:Specificity]
- [http://mic.sgmjournals.org/cgi/content/full/153/12/3923 Paul Williams.:Quorum sensing, communication and cross-kingdom signalling in the bacterial world.Microbiology 153 (2007), 3923-3938]
 "
"